Phó Cục trưởng Cục Quản lý Dược (Bộ Y tế) Nguyễn Tất Đạt vừa qua đã có công văn đề nghị đình chỉ, thu hồi hàng loạt các loại thuốc giả, thuốc có khả năng gây ung thư làm hại tới sức khỏe con người.
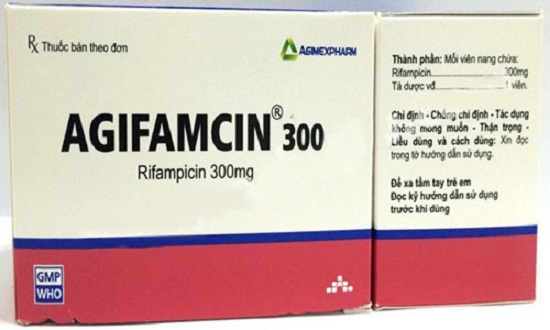
Đình chỉ lưu hành và thu hồi thuốc viên nang Agifamcin 300 giả
Ngày 13/7, Phó Cục trưởng Cục Quản lý Dược (Bộ Y tế) Nguyễn Tất Đạt vừa qua đã có công văn đề nghị đình chỉ lưu hành và thu hồi thuốc viên nang Agifamcin 300 giả, số lô 00916, hạn dùng 22/3/2019.
 Công văn số 13232/QLD-CL về việc đình chỉ lưu hành và thu hồi thuốc viên nang Agifamcin 300 giả, số lô 00916, hạn dùng 22/3/2019.
Công văn số 13232/QLD-CL về việc đình chỉ lưu hành và thu hồi thuốc viên nang Agifamcin 300 giả, số lô 00916, hạn dùng 22/3/2019.
Cụ thể, qua công tác kiểm tra giám sát, về hoạt động sản xuất, kinh doanh thuốc Agifamcin 300 cơ quan kiểm tra chất lượng thuốc đã phát hiện trên thị trường có lưu hành một số hộp thuốc Agifamcin giả, trên nhãn ghi mạo danh nhà sản xuất Công ty cổ phần dược phẩm Agimexpharm và các thông tin SĐK, số lô, hạn dùng thuốc viên nang Agifamcin 300 SĐK: VD-14223-11, số lô 009 16, HD 22/3/2019”, Thuốc giả được phân phối đồng thời với thuốc thật Agifamcin 300 SĐK: VD-14223-11, số lô 00916, HD 22/3/2019 do Công ty cổ phần dược phẩm Agimexpharm sản xuất.
Để đảm bảo an toàn cho người sử dụng, Cục Quản lý Dược yêu cầu đình chỉ lưu hành thuốc trên nhãn ghi: thuốc viên nang Agifamcin 300, số đăng ký VD-14223-11, số lô 00916, hạn dùng 22/3/2019 do Công ty cổ phần dược phẩm Agimexpharm sản xuất. Đồng thời, Cục yêu cầu Công ty Cổ phần dược phẩm Agimexpharm tiến hành thu hồi và tiếp nhận toàn bộ thuốc thật và thuốc giả được trả về từ các cơ sở kinh doanh, sử dụng thuốc. Bảo quản biệt trữ thuốc thu hồi, trả về theo đúng quy định, phối hợp với Viện Kiểm nghiệm thuốc Trung ương hoặc Viện Kiểm nghiệm thuốc Thành phố Hồ chí Minh lấy mẫu, kiểm nghiệm mẫu thuốc thu hồi, trả về.
 Công văn số 13232/QLD-CL về việc đình chỉ lưu hành và thu hồi thuốc viên nang Agifamcin 300 giả, số lô 00916, hạn dùng 22/3/2019.
Công văn số 13232/QLD-CL về việc đình chỉ lưu hành và thu hồi thuốc viên nang Agifamcin 300 giả, số lô 00916, hạn dùng 22/3/2019.
Đối với sở Y tế các tỉnh, thành phố trực thuộc Trung ương, Y tế các ngành Cục yêu cầu các đơn vị thông báo cho các cơ sở kinh doanh, sử dụng thuốc ngừng ngay việc phân phối, sử dụng và thực hiện thu hồi, trả lại đơn vị đã cung cấp thuốc viên nang trên nhãn ghi như trên. Đồng thời, phối hợp với các cơ quan truyền thống thông tin tới các cơ sở buôn bán, sử dụng thuốc và người dân biết để không buôn bán, sử dụng Agifamcin 300 giả có các dấu hiệu nhận biết theo bảng đính kèm công văn này. Tổ chức tiếp nhận thông tin báo cáo của các cơ sở sản xuất, kinh doanh, người sử dụng; phối hợp với các cơ quan chức năng kiểm tra xác minh, truy tìm nguồn gốc xuất xứ của thuốc giả nêu trên, xử lý các tổ chức, cá nhân vi phạm theo quy định hiện hành, Báo cáo kết quả về Cục Quản lý Dược và cơ quan liên quan.
Ngoài ra, Cục quản lý Dược yêu cầu Viện Kiểm nghiệm thuốc Trung ương, Viện Kiểm nghiệm thuốc Thành phố Hồ Chí Minh tiến hành lấy mẫu, kiểm tra chất lượng đối với các lô thuốc viên nang nêu trên được thu hồi, trả về và bảo quản tại kho của Công ty cổ phần dược phẩm Agimexpharm…
Được biết, thuốc viên nang Agifamcin là thuốc trị ký sinh trùng, chống nhiễm khuẩn, kháng vi rút và kháng nấm.
Thu hồi thuốc tim mạch có chứa chất valsartan có khả năng gây ung thư do Công ty Zhejiang Huahai Pharmaceutical của Trung Quốc cung cấp
Trước đó, ngày 10/7 vừa qua Cục đã có công văn ra quyết định thu hồi các loại thuốc chứa chất valsartan có khả năng gây ung thư do Công ty Zhejiang Huahai Pharmaceutical của Trung Quốc cung cấp.
 Công văn số 13232/QLD-CL về việc đình chỉ lưu hành và thu hồi thuốc viên nang Agifamcin 300 giả, số lô 00916, hạn dùng 22/3/2019.
Công văn số 13232/QLD-CL về việc đình chỉ lưu hành và thu hồi thuốc viên nang Agifamcin 300 giả, số lô 00916, hạn dùng 22/3/2019.
Trong công văn do Phó Cục trưởng Cục Quản lý Dược Nguyễn Tất Đạt ký ngày 10/7, ngành y tế Việt Nam đã buộc 8 công ty dược ở Hà Nội, TP.HCM, Bình Dương, Đồng Nai, Đồng Tháp, Vĩnh Long và Phú Yên thu hồi toàn bộ thuốc sản xuất từ nguyên liệu valsartan do Công ty Zhejiang Huahai Pharmaceutical của Trung Quốc sản xuất.
Valsartan là nguyên liệu chính để sản xuất nhiều loại thuốc kê đơn, sử dụng trong điều trị bệnh tim mạch như tăng huyết áp, suy chức năng tâm thất trái sau nhồi máu cơ tim.
Theo công văn của Cục Quản lý Dược, valsartan của Công ty Zhejiang Huahai Pharmaceutical có chứa tạp chất N-nitrosodimethylamine (NDMA) có thể gây ung thư. Vì thế, Cục Quản lý Dược quyết định đình chỉ, thu hồi tất cả các loại thuốc có chứa valsartan nhập từ Công ty Zhejiang Huahai Pharmaceutical, ngừng lập tức việc sử dụng nguyên liệu valsartan của Công ty này. Cục Quản lý Dược cũng ra thời hạn 30 ngày để các công ty nhập khẩu, đăng ký thuốc và sản xuất thuốc gửi báo cáo thu hồi. Đồng thời, kiểm tra giám sát các công ty sản xuất, kinh doanh trên địa bàn thực hiện việc thu hồi các lô thuốc nêu trên, xử lý các đơn vị vi phạm theo quy định.
Cùng với thông báo thu hồi các loại thuốc trên, Cục Quản lý Dược cũng công bố danh sách 14 loại thuốc chứa valsartan bị tạm ngừng nhập khẩu, lưu hành, sử dụng trên lãnh thổ Việt Nam với lý do “chưa có báo cáo về nguồn gốc nguyên liệu”.
 Công văn số 13232/QLD-CL về việc đình chỉ lưu hành và thu hồi thuốc viên nang Agifamcin 300 giả, số lô 00916, hạn dùng 22/3/2019.
Công văn số 13232/QLD-CL về việc đình chỉ lưu hành và thu hồi thuốc viên nang Agifamcin 300 giả, số lô 00916, hạn dùng 22/3/2019.
Được biết, tạp chất NDMA là hóa chất hữu cơ thuộc “gia đình” các chất có khả năng gây ung thư cao (carcinogen). Hóa chất hữu cơ này được sử dụng để sản xuất nhiên liệu lỏng cho tên lửa, các loại hóa chất làm mềm (sử dụng trong nước xả vải), gel lỏng bôi trơn (lubricant) và nhiều sản phẩm khác. Tạp chất này có thể được sản xuất hay hình thành không cố ý trong các phản ứng hóa học và là phụ phẩm của quá trình sản xuất thuốc trừ sâu, chế tạo vỏ xe hơi và chế biến cá.
Mai Quỳnh (Tổng hợp)
Theo Báo Đời sống và Tiêu dùng